I Frankrig kan vaccinenægtere blive nægtet adgang
Det kan blive et krav med en negativ test eller bevis for vaccine for at kunne køre med bus i Frankrig.
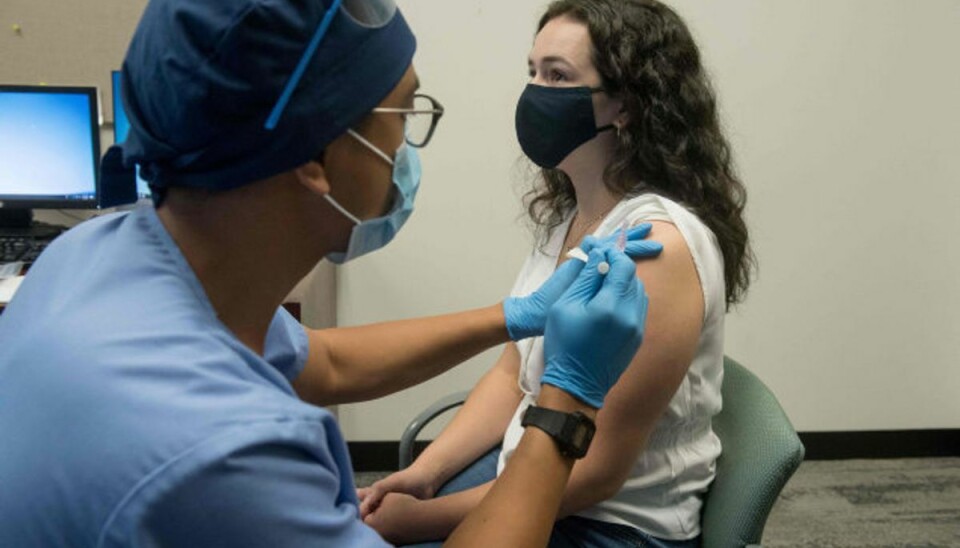
Personer, der ikke bliver vaccineret mod covid-19, risikerer at blive bandlyst fra offentlig transport i Frankrig. Det fremgår af et nyt lovforslag fra regeringen.
Premierminister Jean Castex fik mandag opbakning til forslaget blandt sine ministre. Lovforslaget har til formål at danne juridisk ramme for håndteringen af sundhedskriser, herunder coronaviruspandemien.
Ifølge lovforslaget, som nu vil blive fremlagt for parlamentet, kan det blive nødvendigt med en negativ covid-19-test eller bevis for en “forebyggende behandling, herunder en vaccine” for at få “adgang til transport, bestemte steder samt visse aktiviteter”.
Regeringens vaccineprogram går efter planen i gang på søndag, og myndighederne står allerede nu over for bred modstand mod vaccinen, der er blevet udviklet på rekordtid, efter at Europa blev ramt af pandemien tidligere i år.
Størst modstand
Ifølge en meningsmåling foretaget af avisen Le Journal du Dimanche svarer 59 procent af de adspurgte i Frankrig, at de ikke ønsker at få vaccinen. Dermed er Frankrig et af de lande med størst vaccinemodstand i EU.
Præsident Emmanuel Macron har lovet, at vaccinen mod coronavirus ikke bliver obligatorisk, selv om den stærkt anbefales. Det løfte blev gentaget af sundhedsminister Olivier Véran tirsdag.
– Jeg siger det igen: Vaccination er ikke obligatorisk, sagde han.
Oppositionspolitikere har fordømt lovforslaget. Marine Le Pen, der er leder af højrefløjspartiet National Samling, kalder det “totalitært”.
– Dette lovforslag har ikke til formål at gøre vaccinationer obligatoriske, men det forhindrer enhver, der ikke indordner sig, i at have et socialt liv, siger hun.
Sebastien Chenu fra National Samling siger, at Macrons regering planlægger “et sundhedsdiktatur”.
Danskere også i tvivl
Ikke kun i Frankrig er der skepsis overfor den hastegodkendte vaccine. Bekymring for bivirkninger er den største grund til, at nogle danskere enten er tvivl eller ikke ønsker en coronavaccine. Det viser en rundspørge foretaget af Voxmeter for Ritzau.
24 procent af danskerne er ifølge rundspørgen i tvivl om eller siger nej til en coronavaccine, og ud af dem svarer to ud af tre, at de bekymret for bivirkninger eller vaccinens sikkerhed. Ifølge Flemming Konradsen, der er professor i global sundhed på Københavns Universitet, er der ikke grund til stor bekymring over voldsomme bivirkninger.
Han peger på, at de bivirkninger, der har været fra vaccinens fase 3-studie og fra de første vaccinationer i USA og Storbritannien, er små.
– Nu kan der gå op til to år, inden vi har nok data og viden om negative langtidseffekter. Men med det grundlag vi har nu, er der ikke grund til at være bekymret. Der er de her umiddelbare gener omkring stikstedet, og der har også været enkelte personer, der har meldt om feber og utilpashed, men alt sammen er forbigående og kortvarige, siger han.
Mangler info
Rundspørgen viser også, at 39 procent af dem, der er i tvivl, ikke synes, at de har fået nok information om vaccinen endnu.
Her er der meget at gøre, selv om Sundhedsstyrelsen er ved at sende et informationsbrev ud til alle danskere over 18 år over e-boks, mener Flemming Konradsen.
– Det er ikke nok, at det kun er myndighederne, der melder det ud. Det er en god start, men vi skal også have andre med på banen. Vi ved, at vi skal høre det fra forskellige sider. Folk vi stoler på, folk vi er tæt på, og folk vi har tillid til skal fortælle os, at vi skal gå hen og tage den vaccine.
– Vi skal have din egen praktiserende læger til at bakke op omkring det, og at det bliver omtalt i medierne af folk, der har fået vaccinen. Det skal ikke kun være en pjece, en plakat og i e-boks, siger han.
Godkendt
Til gengæld er andelen af danskere, der ønsker en vaccine, steget siden den seneste rundspørge fra Voxmeter i slutningen af november og starten af december. Her ville 70 procent sige ja til en vaccine, men det tal er nu oppe på 76 procent i den nye rundspørge.
– Godkendelsen af vaccinen gør selvfølgelig en forskel. Det, at den har været igennem en formel proces, og nu er godkendt, tager noget af uvisheden væk, siger Flemming Konradsen.
Han kalder det et “pænt højt antal”, der nu vil vaccineres, men at tallet gerne skulle højere op, før vi er sikre på, at vi opnår en flokimmunitet. Rundspørgen er gennemført fra 15. december til 22. december med svar fra 1088 repræsentative danskere over 18 år.
Vaccinen fra Pfizer, udviklet i samarbejde med tyske BioNTech, blev godkendt til markedsføring i EU-lande mandag aften dansk tid. Først anbefalede lægemiddelagenturet i EU en godkendelse, og få timer senere fulgte kommisionen efter.
Kommisionsformand Ursula von der Leyen kunne således ved en kort videobriefing offentliggøre, at EU nu har det første supervåben mod coronavirus.












